
未来を拓く一歩を支援
助成プロジェクト 成果レポート
【成果報告会レポート】新型コロナウイルス感染症にいち早く挑んだ「チーム阪大」竹田潔氏/大阪大学免疫学フロンティア研究センター拠点長・教授・医学博士

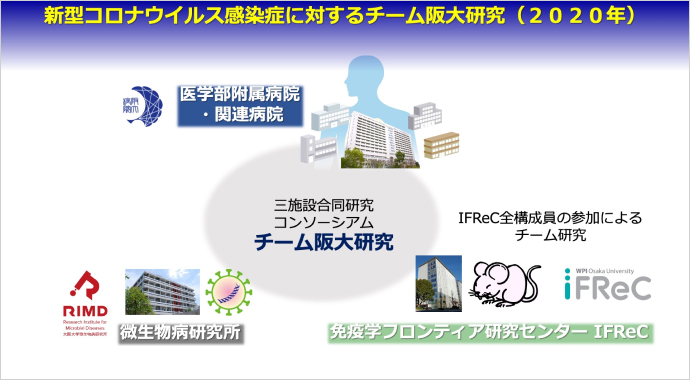
新型コロナウイルス感染症が蔓延していた2020年、その克服に向けていち早く研究を始めたのが大阪大学です。大阪大学では、免疫学フロンティア研究センターを中心に、医学部附属病院、微生物病研究所の3施設が協力して合同研究コンソーシアムを立ち上げ、この3年間で数多くの画期的な研究成果を報告しています。2023年9月11日に開催された成果報告会では、大阪大学免疫学フロンティア研究センター拠点長の竹田潔氏より、研究成果の一部とともに今後の研究体制などについて発表していただきました。
始まりは、組織の枠を超えた有志の集まり
三菱財団は新型コロナウイルス感染症のパンデミックが起きて間もない2020年度に、三菱創業150周年記念事業の一環として三菱グループより資金拠出を受け、新型コロナ感染症関連特別助成を実施しました。その代表的案件として、大阪大学免疫学フロンティア研究センター(以下IFReC/アイフレック)の「新型コロナウイルスによるヒト病態誘導メカニズム」の研究に助成を行いました。
IFReCは日本を代表する免疫学の研究機関で、文部科学省によって2007年に設立されました。現在は大阪大学の36名の主任研究者が所属。ドイツのボン大学、イギリスのユニバーシティカレッジ・ロンドン、オーストラリアのメルボルン大学など海外の研究機関と連携し、世界最先端の免疫学研究に取り組んでいます。2020年に新型コロナウイルス感染症パンデミックが起きたとき、IFReCの拠点長である竹田氏は、すぐに行動を起こさなければと思い立ちました。
「感染症研究にはさまざまな分野があります。例えば私の専門分野である粘膜免疫学は、感染症とは直接関わりがありません。しかし、感染症研究を専門とする者でなくても、それぞれの知識を結集することによって、新型コロナウイルス感染症の根本的な克服に向けた研究を進められるのではと考え、IFReCに所属する主任研究者に個人研究の枠を超えたチーム研究をしませんかと呼びかけたのです。そして全員から即座に、『チーム一丸となって研究しましょう』という力強い返答を得ることができました」
そこに加わったのが、大阪大学医学部附属病院と大阪大学微生物病研究所の研究者の有志です。附属病院では、コロナ感染者からさまざまなサンプルを採取できます。それをもとに、IFReCの研究者がさまざまな機器を用いて免疫応答※について詳細に解析しました。微生物病研究所では、ウイルスそのものの性状の解析、ウイルス感染実験などを行いました。こうして「チーム阪大研究」が動き出したのです。
※免疫応答:ウイルスやアレルゲンなど有害な侵入者から身を守るために生体内で起こる反応。
「新型コロナウイルスの研究は社会的な使命としてスタートしましたが、当初は研究費の目処は立っていませんでした。しかし、2020年度に三菱財団からいただいた研究助成によって、チーム阪大研究を大きく推進することができました」
チーム阪大研究より6つの成果を解説
基礎免疫学、臨床医学、ウイルス学の知を結集した研究体制により、チーム阪大に参画する69の研究室から(2023年7月末現在)、2021年1月から2023年3月までに、新型コロナウイルスに関連して140の論文を発表しました。研究成果報告会では、そのうち6つについて竹田氏が発表しました。
新型コロナウイルス感染症が重症化する仕組みとは?
最初は、「新型コロナウイルス感染症の重症化を引き起こすサイトカインストームの仕組み」に関する姜秀辰(カン・スジン)寄付研究部門助教、岸本忠三特任教授らによる研究グループの成果です。
ウイルスや細菌などの微生物に対する生体防御をになう物質がサイトカインですが、大量に血中に放出されることで過剰な炎症反応が起き、さまざまな臓器に致命的な損傷を与えるサイトカインストームという病態を引き起こします。
新型コロナウイルスに感染すると、早い段階で血管内皮細胞からサイトカインの一種であるIL-6(インターロイキン・シックス)が産生※されます。研究グループは、血液中にIL-6が増加すると、血液を凝固させる分子PAI-1(パイ・ワン)が血管から放出されることを発見しました。PAI-1によって血液が凝固し、血栓ができると、血管が傷ついて血液中の液性成分が漏れ出し、サイトカインストームが起こります。
※産生:細胞により物質が作り出されること。
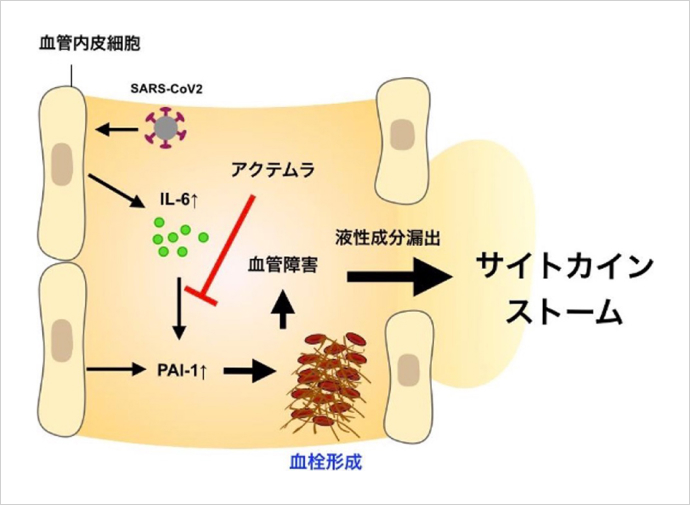
新型コロナウイルス感染症の重症化や死亡と深く関わっているとして、広く知られるようになりました。研究グループの報告は、IL-6の働きを抑える薬を使うきっかけの一つとなり、重症化予防などに貢献しました。
新型コロナウイルス感染症の重症化を防ぐT細胞を発見
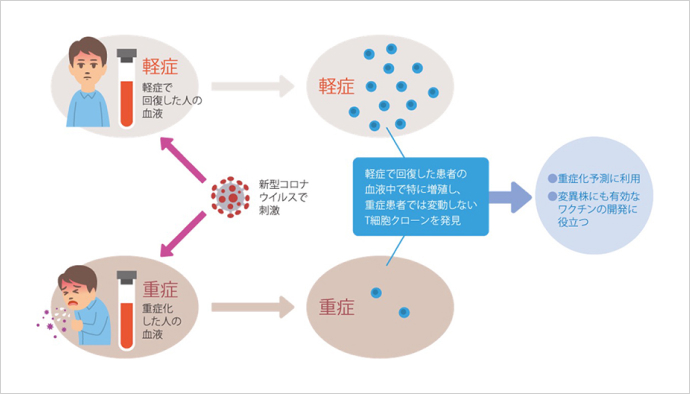
2番目は、新型コロナウイルス感染症の重症化を防ぐT細胞※についての山崎晶教授らの報告です。研究グループは、新型コロナウイルス感染者のうち、軽症で済んだ人と重症化した人それぞれの血液を採取し、解析しました。その結果、軽症で回復した患者の血液で増加している「T細胞クローン」を発見。この細胞には重症化を抑える働きがあり、これを持つ人は重症化しにくいことも突き止めました。
※T細胞:免疫応答の司令塔的役割を担うリンパ球。異物として認識された病原体を間接的に攻撃するヘルパーT細胞、ウイルス感染細胞やがん細胞を直接排除するキラーT細胞に大きく分かれる。
新型コロナウイルスの感染を増強する抗体とは?
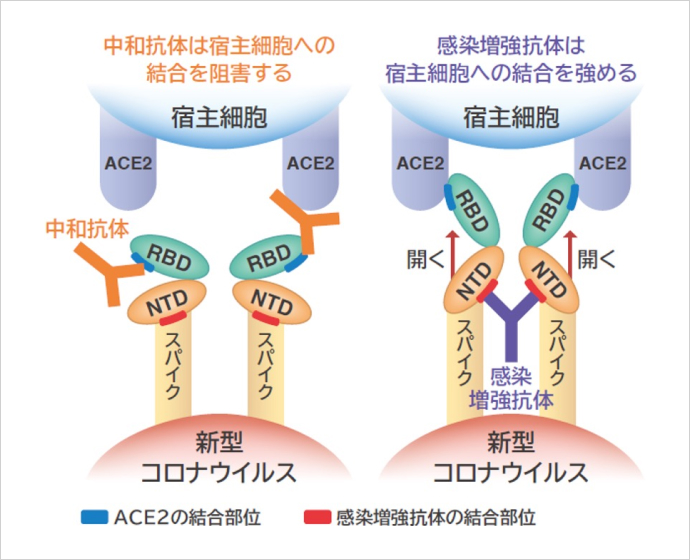
3番目は、新型コロナウイルスの感染を増強する抗体についての荒瀬尚教授の報告です。通常、ウイルスなどに感染すると体内で「中和抗体」がたくさん作られます。中和抗体は私たちの細胞とウイルスが結合するのを邪魔して、症状を抑える役割があります。ところが新型コロナウイルスに感染すると、中和抗体だけでなく、感染性を高める「感染増強抗体」も産生され、それが重症化に関わる可能性があるのです。
荒瀬教授らはさらに、そのメカニズムも解明しました。新型コロナウイルスの表面には、スパイクタンパク質というトゲのようなものが生えていて、その先端が私たちの細胞にあるACE2(エース・ツー)という受容体に結合すると感染するため、中和抗体はそれらが結合しないようにブロックします。一方、感染増強抗体はスパイクタンパク質の立体構造を変化させて開き、ACE2とスパイクタンパク質を結合しやすくして感染を強めるのです。
「女性より男性のほうが重症化しやすい」要因は?
4番目は、新型コロナウイルスに対する免疫応答の男女差についてのジェームズ・ウィング准教授らの報告です。同感染症の重症化の程度には男女差があり、女性に比べて男性のほうが重症化しやすいと言われていました。ウィング准教授らが抗体反応の男女差について解析した結果、感染している間はすべての患者で、抗体を適正に産生するのに重要な濾胞性制御性T細胞(Tfr)が減少していることを確認しました。この傾向は女性より男性の方が強く、重症化につながりやすいことを確認しました。
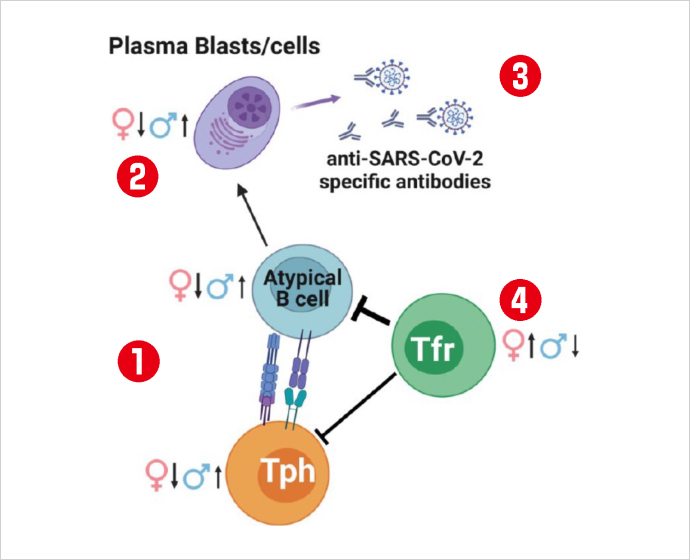
感染に素早くB細胞(Atypical B cell)が反応し、末梢性ヘルパーT細胞(Tph)との相互作用(①)により抗体産生を担うプラズマブラスト(Plasma Blasts)となり(②)、新型コロナウイルスに対する抗体(anti-SARS-CoV-2)を産生する(③)。この抗体産生を調整している濾胞性制御性T細胞(Tfr)が減少する傾向が男性のほうが強いことがわかった(④)。※三菱財団 成果報告会講演資料より(提供:大阪大学)
mRNAワクチンによる自然免疫応答メカニズムの一端を解明
5番目は、新型コロナウイルスに対応するmRNAワクチンがもたらす「自然免疫記憶の成立」に関する、熊ノ郷淳教授らの報告です。ヒトの免疫系には、先天的にそなわり、病原体にたいして最初に働く「自然免疫」と、自然免疫の応答に引き続いて働き、抗体産生に関わる「獲得免疫」があります。これまで多く利用されてきたワクチンは、ウイルスの一部を体内に投与し、「獲得免疫」を利用して免疫を作る仕組みです。これに対して、新型コロナウイルス感染症に対応するために新たに開発されたmRNAワクチンはウイルスの遺伝情報の一部を投与し、体内でウイルスのタンパク質の一部が作られた後、それに対する免疫をつくるという仕組みです。これも獲得免疫を利用した仕組みですが、これとは別に、「自然免疫」も活性化させることがわかっています。しかし、そのメカニズムはこれまで明らかになっていませんでした。
熊ノ郷教授らは、1回目のワクチン接種後に新型コロナウイルスが自然免疫システムにも一時的に記憶されること、さらに2回目の接種ではウイルスを排除するインターフェロン応答※が増強することを確認しました。これによってmRNAワクチンの効果が強くなるのです。
※インターフェロン応答:抗ウイルス応答の一つ。重症コロナ患者では、インターフェロン応答の低下が見られると複数報告される。
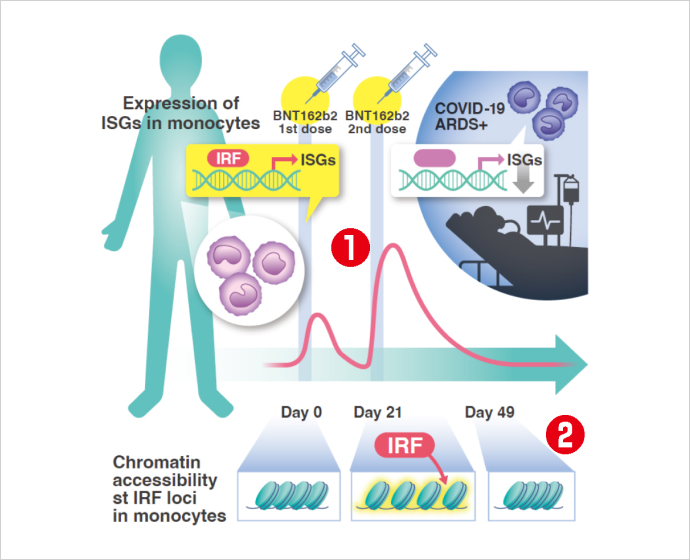
1回目のワクチン接種後(BNT162b2 1st dose)よりも、2回目のワクチン接種後(BNT162b2 2nd dose)の方が単球におけるインターフェロン誘導遺伝子(Interferon stimulated genes, ISG)の発現が促進している(①)。また、1回目接種後からインターフェロン制御因子Interferon Regulatory Factor, IRF)がアクセスしやすい状態になり、抗ウイルス応答が高くなる。しかし、この変化は2回目の接種1ヶ月後には消失している(②)。※三菱財団 成果報告会講演資料より(提供:大阪大学)
3回目の接種がオミクロン株に有効なのはなぜ?
6番目もワクチンの効果に関する井上毅特任准教授、黒﨑知博特任教授らの研究報告です。新型コロナウイルスに対するmRNAワクチンの2回の接種によって作られる抗体はオミクロン株に対してほとんど効果がありませんでした。しかし3回接種するとオミクロン株にも有効という報告があります。研究グループはそのメカニズムを解明しました。
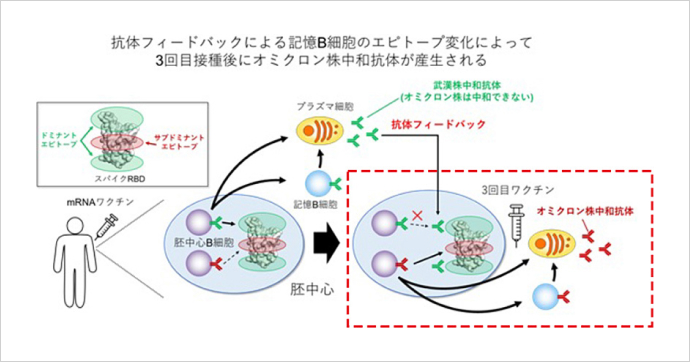
ワクチンにはウイルスに対する抗体を作る働きがありますが、他に「記憶B細胞」を活性化させる働きがあります。記憶B細胞は免疫細胞の一種で、記憶していた抗原(ウイルスなど)の刺激を受けるとすぐに多量の抗体を作ることができます。研究グループがワクチンを接種した人のB細胞を解析したところ、3回目を接種すると記憶B細胞がオミクロン株も中和できる抗体を産生できるようになることを突き止めました。
今回の成果報告会では、以上6つの研究の成果について報告がありましたが、これらは、チーム阪大による研究成果のごく一部です。チーム阪大は研究成果を取りまとめた「OUリサーチ・トゥデイ(OUはOsaka University)」と名付けた広報誌を作成し、広く社会に発信しています。

感染症の次なる脅威に備えるために
チーム阪大の活動により、大阪大学では将来の感染症に対しても対策を講じるべきとの機運が高まり、2021年4月に「感染症総合教育研究拠点(CiDER・サイダー)が設立されました。現在、チーム阪大の研究メンバー全員がここで研究活動を行っています。また、2022年にはワクチン開発拠点「CAMaD(カマド)」も設立されました。
「最初は3施設の有志で立ち上げた小さなチーム阪大でしたが、現在はオール阪大に発展し、研究活動を進めています。新型コロナウイルス感染症のパンデミックは収束しましたが、次なる感染症のパンデミックに迅速に対応できるように、チーム阪大研究をさらに継続、発展させていきたいと考えています」

プロフィール
大阪大学免疫学フロンティア研究センター(IFReC)
IFReCは、文部科学省が世界の頭脳を惹きつける国際的な研究拠点を構築し、我が国に国際的な頭脳循環のハブを作ることを目指すことを目的としたWorld Premier International Research Center Initiative (WPI)の一つとして大阪大学に2007年に設置された。Imaging, informaticsを融合し、世界最先端の免疫学研究を展開している。2017年からは、製薬企業との包括連携を締結し、ヒト免疫学研究を中心として、免疫疾患克服を目指した基礎研究を展開している。